
产品货号:
SY0021
中文名称:
多点突变试剂盒
英文名称:
HiperMut Multi Site-Directed Mutagenesis Kit
产品规格:
10T
发货周期:
1~3天
产品价格:
询价
本试剂盒是基于HiperClone快速克隆技术的定点突变系统。使用本试剂盒,可一次性向目标质粒上三至五个不连续位点(相距超过50bp)同时引入定点突变。该试剂盒由两个模块组成:Hiper II Pfu DNA Polymerase扩增模块和HiperClone快速克隆模块。Hiper II Pfu DNA Polymerase超高的保真度显著降低了扩增过程中引入新突变的可能性,其卓越的长片段扩增能力,广泛适用于长度小于20kb的任何质粒扩增。HiperClone快速克隆系统利用高效的同源重组反应替代传统的退火成环反应。因此使用本试剂盒进行DNA定点突变时,引物设计更加灵活,且扩增反应以指数方式进行,极大减少了模板使用量,有利于原始甲基化模板的彻底降解。
本试剂盒中的重组酶Exnase MultiS经过优化,专门针对多碱基进行定点突变。此外,如扩增产物特异,其DpnI消化产物可不进行DNA纯化而直接用于重组反应。高度优化的反应缓冲液、快捷的操作流程以及极高的成功率,使得本试剂盒成为DNA多点突变试剂盒。

| 组分 | 规格 |
| 2×Hiper II PCR buffer | 1.25mL |
| dNTP Mix (10mM each) | 50μL |
| Hiper II Pfu DNA Polymerase (1U/μL) | 50μL |
| Dpn I (10U/μL) | 50μL |
| 2×HiperClone MultiS Enzyme Premix | 100μL |
保存:-20℃,有效期1年。

- 引物设计时5’端反向互补区尽量选择无重复序列,且GC含量比较均匀的区域。当这一区域内GC含量在40%~60%范围之内时,重组环化效率将达到最大。如这部分区域GC含量高于70%或者低于30%,重组环化效率会受到较大影响。
- 如使用本品对质粒进行定点突变,请使用甲基化酶无缺陷的宿主菌(例如Top10、DH5α、JM109)扩增原始质粒!
- 当两突变位点相距小于50bp时,应将其视为一个突变位点,将两突变引入同一条/对引物进行实验。
- DpnI只能识别甲基化DNA,请务必使用从甲基化酶无缺陷的宿主菌中扩增的质粒作为PCR模板。
- 质粒PCR扩增结果需高度特异,杂带较多会影响实验结果。
- 重组反应体系中应尽量避免金属络合剂(如EDTA)的带入。因此,建议将DNA纯化产物溶解在pH8.0的ddH2O中保存(常规胶回收试剂盒中的洗脱液可用pH8.0的ddH2O替代),请勿使用TE进行DNA保存。
- 冷却后的反应产物应在1h内进行转化,且转化前保持在冰水浴中。如需储存,于-20℃冻存。尽量避免室温较长时间放置或4℃长期储存。
- 反应产物的转化体积不应超过感受态细胞体积的1/10,否则会降低转化效率。另外,当转化的DNA浓度太高时,会抑制转化反应。将重组反应产物稀释5倍后取1/5进行转化。
- 为了您的安全和健康,请穿实验服并戴一次性手套操作。
- 本制品仅作科研用途!

不连续多碱基(相距超过50bp)定点突变实验流程(以不连续三碱基为例)
一、实验流程概览
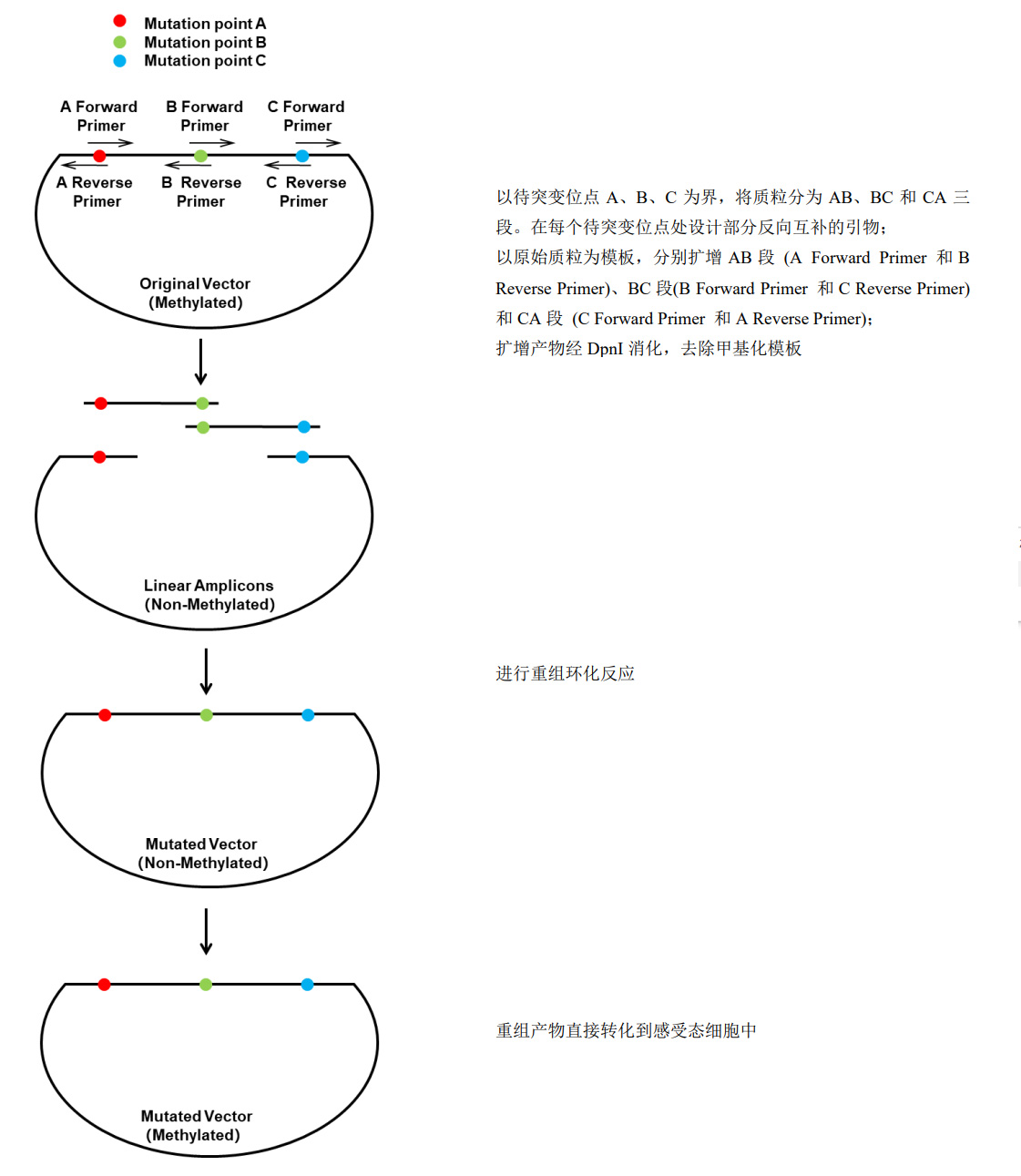
图1.使用HiperMut Multi Site-Directed Mutagenesis Kit进行不连续三碱基定点突变实验流程
二、操作步骤:
- 引物设计
向质粒三个不连续位点引入定点突变,只需设计三对引物将质粒分段扩增即可。引物设计基本原则为:在每个待突变位点处设计部分反向互补的扩增引物对。每对正反向引物5’端包含15~21bp反向互补区域(GC含量40%~60%为佳),各引物待突变位点至引物3’端区域Tm值高于60℃为佳。所需引入突变可以包含在互补区域内(需要两条引物上均引入点突变),也可以包含在任一条引物的非互补区域(只需在一条引物上引入点突变),请勿将突变位点置于引物末端。以向pUC18引入三碱基突变为例,引物设计具体方案如图2所示。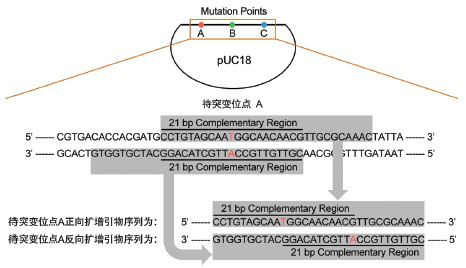
图2.向质粒引入不连续多碱基定点突变引物设计示意图
注:待突变位点B、C处的正反向扩增引物设计方式与位点A处的引物设计方式一致。计算引物Tm值时,应计算待突变位点至引物3’端这一区域内的碱基,待突变位点至引物5’端区域内的碱基不应参与计算。 - 目标质粒分段扩增
以待突变位点A、B、C为界,将质粒分为AB、BC段和CA段。使用Hiper II Pfu DNA Polymerase对各段分别进行扩增。AB段扩增引物对为:待突变位点A正向扩增引物和待突变位点B反向扩增引物;BC段扩增引物对为:待突变位点B正向扩增引物和待突变位点C反向扩增引物;CA段扩增引物对为:待突变位点C正向扩增引物和待突变位点A反向扩增引物。- 配制PCR反应体系
反应各组分解冻后请充分摇匀,使用完毕后及时放回-20℃。2×Hiper II PCR buffer请勿长时间敞口放置。
为了增加扩增特异性,反应体系配制过程请于冰水浴中进行。为了防止Hiper II Pfu DNA Polymerase的校对活性降解引物,请将聚合酶最后加入反应体系中。
推荐反应体系如下:成分 用量 ddH2O 至50μL 2×Hiper II PCR buffer 25μL dNTP Mix (10mM each)a 1μL 模板DNAb Optional 引物1 (10μM) 2μL 引物2 (10μM) 2μL Hiper II Pfu DNA Polymerase (1U/μL)c 1μL
注:- 请勿使用dUTP和带有尿嘧啶的引物或模板。
- 在各片段能正常扩增的前提下,应尽量减少质粒模板使用量,推荐≤1ng。待扩增质粒长期放置、反复冻融会导致模板质粒断裂、开环或降解,因此推荐使用新鲜制备的质粒作为模板。
- 推荐的酶的终浓度为1U/50μL反应。可将Hiper II Pfu DNA Polymerase在0.5~2U/50μL之间进行优化,但不要超过2U/50μL,尤其当扩增子长度大于5kb时。
- 请勿使用dUTP和带有尿嘧啶的引物或模板。
- PCR扩增反应
循环步骤 温度 时间 循环数 预变性 95℃ 30sec 1 变性a
退火b
延伸c95℃
60℃~72℃
72℃15sec
15sec
30~60sec/kb30d 彻底延伸 72℃ 5min 1
注:- 对于大多数质粒,变性温度使用95℃即可。
- Hiper II Pfu DNA Polymerase能够促进模板和引物高效退火。一般来说,退火温度设置为引物Tm值即可。如果需要,可以建立一个温度梯度反应去寻找引物模板结合的最适温度。退火时间太长可能导致扩增产物在胶上呈现弥散状。
- 对于大多数扩增反应,延伸过程可在72℃进行。长的延伸时间有助于提高扩增产量。
- 为了防止扩增过程中引入非目标突变,强烈建议扩增循环数≤35。如果扩增效率良好的话,推荐扩增循环数应≤30。
反应结束后取少量扩增产物进行琼脂糖电泳检测。如目标质粒正确扩增,则可进行下步实验。 - 对于大多数质粒,变性温度使用95℃即可。
- 配制PCR反应体系
- 扩增产物DpnI消化,去除甲基化模板质粒
因上述扩增产物中包含原始模板质粒,为防止其在转化后形成假阳性转化子,必须在进行重组环化之前进行DpnI消化。
推荐反应体系如下:成分 用量 DpnI 1μL 扩增产物 40~50μL
将上述反应体系置于37℃恒温反应1~2小时。如产物扩增特异,产物条带单一,DpnI消化产物无需纯化,可直接用于后续重组反应。如扩增不特异,DpnI消化结束后应胶回收纯化目标扩增产物。 - 重组反应
- 配制重组反应体系
质粒AB、BC和CA段扩增产物末端分别包含相对应的完全一致的一段序列,因此在Exnase MultiS催化下三扩增产物末端可以发生同源重组,完成扩增产物环化过程。于冰水浴中,将下列组分依次加到无菌的1.5mL Eppendorf管或PCR管的管底。如果不慎将液体粘在管壁,请务必通过短暂离心使其沉入管底。体系配制完成后,用移液器上下轻轻吹打几次混匀各组分,避免产生气泡(请勿剧烈震荡或者涡旋混匀)。成分 用量 ddH2O Up to 20μL AB段DpnI消化产物 x ng BC段DpnI消化产物 x ng CA段DpnI消化产物 x ng 2×HiperClone MultiS Enzyme Premix 10μL
Exnase MultiS多点突变重组反应体系最适DNA使用量为每片段0.03pmol。该摩尔数对应的DNA质量可由以下公式粗略计算获得:
DpnI消化产物最适使用量= [0.02×目标质粒碱基对数] ng (0.03pmol)
例如,AB段长度为1kb,BC段长度为2kb,CA段长度为5kb。则DpnI消化产物最适使用量为:AB段0.02×1000 = 20ng;BC段0.02×2000 = 40ng;CA段0.02×5000 = 100ng。
注:DNA量太多或者太少都将降低环化效率。常用的吸光度测量法极易受DNA纯度、DNA稀释液pH等因素影响,测定值和DNA实际浓度往往偏差较大。因此,请务必通过琼脂糖电泳预先确认DNA浓度,尽量严格按照推荐量配制反应体系。当DpnI消化产物最适使用量计算值不足10ng或者超过200ng时,加入10ng或200ng即可。DpnI消化产物不纯化直接用于重组反应时,使用量不应超过反应总体积的1/5,即4μL。 - 重组反应
- 将上述体系置于50℃反应20~50min。
- 待反应完成后,立即将反应管置于冰水浴中冷却5min。
- 之后,反应产物可直接进行转化;也可储存于-20℃,待需要时解冻转化。
- 将上述体系置于50℃反应20~50min。
- 配制重组反应体系
- 反应产物转化、涂板、克隆鉴定
- 取10μL冷却反应液,加入到100μL感受态细胞中,轻弹管壁数下混匀,在冰上放置30min。
- 42℃热激45~90秒,冰水浴孵育2min。
- 加入900μL SOC或LB培养基,37℃孵育10min充分复苏。
- 37℃摇菌45min。
- 取100μL菌液均匀涂布在含有适当抗生素的平板上。将平板倒置,于37℃过夜培养。
注:我们推荐您使用转化效率>108 cfu/μg的感受态细胞。如果感受态转化效率<108 cfu/μg (例如用CaCl2法新鲜制备的感受态转化效率通常在106-107 cfu/μg之间),请将培养菌液在5000rpm离心3min收集菌体,用100μL LB培养基重悬后全部涂板。
- 取10μL冷却反应液,加入到100μL感受态细胞中,轻弹管壁数下混匀,在冰上放置30min。
相关搜索:多点突变试剂盒,HiperMut Multi Site-Directed Mutagenesis Kit



